Home »
KULTUR JARINGAN
» PRODUKSI BIBIT TANAMAN ANTHURIUM, NANAS, KRISAN DAN SEMANGKA
PRODUKSI BIBIT TANAMAN ANTHURIUM, NANAS, KRISAN DAN SEMANGKA
Written By jual peralatan laboratorium on Saturday, January 4, 2014 | 9:30 PM
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Penyediaan bibit dalam pengembangan suatu tanaman atau dalam suatu
proses produksi merupakan salah satu aspek yang sangat penting. Proses
produksi skala besar seperti tanaman hortikultura akan memerlukan bibit
dalam jumlah besar, bibit dari varietas unggul, bebas hama dan penyakit
dan penyediaan yang kontinyu. Bibit dari suatu varietas unggul yang
dihasilkan oleh pemulia tanaman jumlahnya sangat terbatas, sedangkan
bibit dibutuhkan sangat banyak. Beberapa tanaman hortikultura banyak
yang sulit diperbanyak dengan konvensional baik secara vegetatif maupun
generatif, selain itu bila diperbanyak dengan cara cangkok, stek, atau
penempelan memerlukan bahan tanaman yang sangat besar untuk medapatkan
bibit dalam jumlah besar (Ekawati, 2008).
Produksi Bibit Tanaman Hortikukultura merupakan produksi bibit dengan
menggunakan teknik kultur jaringan dan teknik mikropropagasi. Kultur
jaringan tanaman adalah suatu sistem perbanyakan tanaman yang diambil
dari bagian tanaman yang ditanamkan dalam media buatan, dengan kondisi
yang steril kemudian beregenerasi menjadi tanaman lengkap. Teknik
mikropropagasi adalah metode pengembangbiakan/perbanyakan tanaman yang
menggunakan bagian tanaman yang berukuran sangat kecil seperti potongan
organ, jaringan, sel dalam kondisi aseptik menggunakan teknik kultur
in-vitro. Kelebihan teknik mikropropagasi yaitu : hanya membutuhkan
jaringan atau bahan tanaman sedikit, tidak membutuhkan tempat yang luas,
bebas dari patogen (cendawan dan bakteri), dapat dibebaskan dari virus,
tingkat perbanyakan tinggi, dapat memproduksi tanaman yang sulit
diperbanyak secara konvensional, tidak tergantung musim, stok tanaman
dapat disimpan dalam waktu lama. Selain itu, mempunyai kelebihan teknik
mikropropagasi juga memilki permasalahan yaitu: perlu keterampilan
khusus; memerlukan fasilitas khusus; metode setiap spesies tidak sama;
dan tanaman yang dihasilkan berukuran kecil (Sugito, Budiarta, Purwito,
2007).
Teknik mikropropagasi pada produksi bibit tanaman hortikultura memilki
berbagai metode yang dapat dilakukan yaitu : metoda multiplikasi tunas
aksilar, multiplikasi tunas samping, multiplikasi melalui pembentukan
tunas adventif dan multiplikasi melalui embrio somatik. Dalam
mikropropagasi totipotensi dan diferensiasi merupakan dasar terjadinya
morfogenesis. Totipotensi adalah sel-sel mampu berdiferensiasi pada
lingkungan tertentu sedangkan dediferensiasi merupakan proses kebalikan
dari diferensiasi yaitu sel-sel yang telah berdeferensiasi berubah
kembali menjadi sel-sel yang tidak terdiferensiasi (sel-sel
parenimatis).
Praktik produksi bibit tanaman hortikultura ini diharapkan mahasiswa
dapat terampil, lebih mengetahui dan memahami dengan jelas, baik dalam
ilmu pengetahuan dan praktikum produksi bibit tanaman hortikultura yang
dilaksanakan.
1.2 Tujuan
Praktikum produksi bibit tanaman hortikultura ini diharapkan :
1. Agar mahasiswa mampu membuat media, inisiasi dan subkultur pada
produksi bibit tanaman anthurium, nanas, semangka, dan krisan.
2. Untuk mengetahui pengaruh media MS1 – MS8 pada subkultur tanaman
anthurium.
3. Untuk mengetahui keberhasilan inisiasi pada tanaman nanas.
4. Untuk mengetahui keberhasilan inisiasi pada jenis eksplan dengan
macam bahan sterilan.
5. Untuk mengetahui keberhasilan inisiasi eksplan biji semangka.
BAB 2. TINJAUAN PUSTAKA
2.1 Tinjauan Tanaman
2.1.1 Anthurium
2.1.1.1 Sekilas anthurium
Anthurium merupakan tanaman hias komersial di Indonesia. Tanaman ini
disukai konsumen karena keindahan warna serta variasi bunga dan daun
yang beragam. Karena sifatnya yang memerlukan naungan dan tempat teduh,
tanamn ini lebih tepat dijadikan tanaman hias indoor. Selain berbunga
indah daunnya juga tampak unik. Kelebihan bunga anthurium antara lain
kesegarannya bisa bertahan lama. Bila masih berada di negaranya, bunga
bisa tetap segar selama sekitar 15 hari. Namun bila dipotong bias
bertahan kurang lebih 14 hari (Budhiprawira dan Saraswati, 2007).
Anthurium termasuk tanaman dari keluarga Araceae. Tanaman berdaun indah
ini masih berkerabat dengan sejumlah tanaman hias populer semacam
aglaonema, philodendron, keladi hias, dan alokasia. Dalam keluarga
araceae, anthurium adalah genus dengan jumlah jenis terbanyak.
Diperkirakan ada sekitar 1000 jenis anggota marga anthurium.
Tanaman ini termasuk jenis tanaman evergreen atau tidak mengenal masa
dormansi. Di alam, biasanya tanaman ini hidup secara epifit dengan
menempel di batang pohon. Dapat juga hidup secara terestrial di dasar
hutan. Daya tarik utama dari anthurium adalah bentuk daunnya yang indah,
unik, dan bervariasi. Daun umumnya berwarna hijau tua dengan urat dan
tulang daun besar dan menonjol. Sehingga membuat sosok tanaman ini
tampak kekar namun tetap memancarkan keanggunan tatkala dewasa. Tidak
heran bila tanaman ini memiliki kesan mewah dan eksklusif. Di masa lalu,
anthurium banyak menjadi hiasan taman dan istana kerajaan-kerajaan di
Jawa. Konon, dipuja sebagai tanaman para raja.
Secara umum anthurium dibedakan menjadi dua yaitu jenis anthurium daun
dan jenis anthurium bunga. Anthurium daun memiliki daya pikat terutama
dari bentuk-bentuk daunya yang istimewa. Sedangkan anthurium bunga lebih
menonjolkan keragaman bunga baik hasil hibrid maupun spesies. Biasanya
jenis anthurium bunga dijadikan untuk bunga potong (Wikipedia, 2009).
2.1.1.2 Perbanyakan Anthurium
Menurut Budhiprawira dan Saraswati (2007) seperti halnya keluarga
Araceae yang lain, anthurium bisa diperbanyak secara generatif maupun
vegetatif. Perbanyakan generatif yaitu dengan menggunakan biji. Biji
bias diperoleh dari penyerbukan alami maupun hasil persilangan.
Masing-masing varietas memiliki warna dan ukuran biji yang berbeda.
Sementara perbanyakan vegetatif dapat dilakukan dengan cara setek,
pemisahan anakan, dan kultur jaringan. Keuntungan perbanyakan vegetatif
adalah keturunannya (genersi) mempunyai sifat-sifat sama dengan induknya
dan cepat menghasilkan tanaman yang berukuran besar atau menghasilkan
bunga. Umumnya anthurium bunga untuk bunga potong diperbanyak dengan
kultur jaringan karena dapat menghasilkan tanaman yang seragam dan
kualitasnya terjamin.
Secara konvesional perbanyakan anthurium dilakukan melalui biji dan
pemisahan anakan. Namun hasilnya tidak bisa memenuhi permintaan konsumen
dalam skala besar karena memerlukan waktu yang lama untuk mendapatkan
biji atau anakan. Melalui biji diperlukan waktu lebih kurang 3 tahun
sejak penyerbukan, biji masak, hingga tanaman remaja. Sementara
pemisahan anakan memerlukan waktu antara 6-12 bulan untuk siap
dipisahkan dan waktu pendewasaan (hingga tanaman siap dijual) sekitar
6-8 bulan, sehingga dengan kultur jaringan merupakan salah satu teknik
perbanyakan alternatif pada tanaman anthurium. Melalui teknik ini, sel
atau jaringan tanaman yang diisoloasi dari bagian tanaman, seperti
protoplasma, sel atau sekelompok sel, yang selanjutnya disebut eksplan,
dirangsang untuk membentuk tanaman utuh menggunakan media dan lingkungan
tumbuh yang sesuai. Pada media aseptik yang mengandung unsur hara makro
dan mikro serta zat pengatur tumbuh yang diperlukan tanaman dan eksplan
tersebut akan membelah dan membentuk kalus atau organ tanaman secara
langsung (tunas/akar). Selanjutnya, kalus ini akan dirangsang untuk
membentuk tanaman utuh.
2.1.2 Nanas
2.1.2.1 Sekilas Tentang Nanas
Nenas atau nanas atau “phineappel” bukan tanaman asli Indonesia.
Berdasarkan narasumber tanaman ini berasal dari benua Amerika yaitu
benua Colombus pada tahun 1493 di pulau Guadelopus tumbuh subur tumbuhan
nanas, dan tahun 1502 hampar tanaman ini meluas di pantai Puerto Bello.
Tanaman nanas selanjutnya berkembng meluas ke seluru dunia yang beriklim
panas adalah brazilia (amerika selatan). Selanjutnya nenas masuk
kewilayah Indonesia pada abad ke-15 tepatnya pada tahun 1599. Penyebaran
nenas di Indonesia pada mulanya sebagai tanaman pengisi di lahan
pekarangan, tetapi lamban laun meluas ke kebun lahan kering (tegalan) di
seluruh wilayah nusantara (Rukmana, 2001).
Menurut Rukmana (2001) prospek agrobisnis buah-buahan, khususnya nenas,
sangat cerah baik di pasaran dalam negeri (domestik) maupun pasaran luar
negeri (ekspor). Permintaan di pasaran dalam negeri terhadap buah nenas
cenderung terus meningkat sejalan dengan pertumbuhan jumlah penduduk,
makin baiknya pendapatan masyarakat, makin tingginya kesadaran penduduk
dengan nilai gizi dari buah-buahan. Permintan pasar dunia terhadap nenas
oleh beberapa negara pengimpor cukup besar. Hal ini berkaitan dengan
tingkat konsumsi di beberapa negara maju cukup tinggi. Seperti pada
tahun 1983 – 1985 di Amerika Utara rata-rata 10,1 kg/kapita/tahun, A.S.
9,8 kg, Kanada 10.5 kg, Eropa Barat 6.5 kg. Negrara pengimpor nenas
kalengan adalah Jepang rata-rata 18.371 ton/tahun.
Keguanaan nenas yang bernilai ekonomi penting adalah buahnya. Buah nenas
selain di konsumsi segar juga dapat diolah berbagai macam makanan atau
minuman, seperti selai, buah dalam sirop, dan lain-lain. Rasa buah nenas
manis agak sampai agak masam menyegarkan, sehingga disukai oleh
masyarakat luas. Selain itu juga mengandung gizi yang cukup tinggi dan
lengkap.
Sistem perakaran tanaman nenas sebagian tumbuh dalam tanah dan
sebagiannya menyebar di permukaan tanah. Bentuk batang tanaman nenas
mirip gada, berukuran cukup panjang antara 20 – 25 atau lebih, tebal
dengan diameter 2,0 – 3,5 cm, ruas buku buku pendek, batang sebagai
tempat melekat daun, buah, tunas, sehingga tidak kelihatan.
Daun nenas tumbuh memanjang sekitar 130 – 150 cm, lebar antara 3 – 5 cm
atau lebih, pinggir daun ada yang berduri dan ada yang tanpa duri,
permukaan daun sebelah atas mengkilap berwarna hiajau – tua atau warna
merah – tua atau bergaris merah merah kecoklatan. Bunga atau buah nenas
muncul pada ujung tanaman. Bunga nenas tersusun dalam tangakai yang
berukuran leratif panjang antara 7 – 15 cm atau lebih.
2.1.2.2 Perbanyakan Nanas
Tanaman nenas dapat diperbanyak dengan menggunakan bibit vegetatif,
seperti anakan yang tumbuh pada bagian batang di bawah tanah tunas
samping yang tumbuh pada batang, tunas mahkota di atas buah, tunas yang
tumbuh pada bagian tangkai buah. Pembungaan nenas dapat dipercepat
dengan pemberian bahan kimia atau dengan pengasapan. Hormon asetin dapat
merangsang pembungaan nenas, caranya ialah 1 gram kalsium karbit
dibubuhkan pada titik tumbuh ujung tanaman atau sela-sela daun. Hormon
NAA dengan kosentrasi 10 – 100 ppm juga dapat mempercepat pembungaan
nenas tersebut. Hormon ini dapat mempercepat pembungaan sekaligus
pematangan buah (Rukmana, 2001).
2.1.3 Krisan
2.1.3.1 Sekilas Tentang Krisan
Krisan merupakan salah satu jenis bunga potong penting di dunia. Bahkan
akhir-akhir ini penggunaan krisan makin bertambah, karena sering juga
dijadikan tanaman hias pot. Negara produsen bunga potong dan tanaman pot
di dunia adalah Belanda. Diantara 10 jenis bunga potong komersial
Belanda, krisan menempati urutan kedua setelah mawar (Rukmana dan
Mulyana, 2006). Krisan tanaman bunga hias berupa perdu dengan sebutan
lain Seruni atau Bunga Emas (Golden Flower) berasal dari dataran Cina.
Krisan kuning berasal dari dataran Cina, dikenal dengan Chrysanthenum
indicum (kuning), C. morifolium (ungu dan pink) dan C. daisy (bulat,
ponpon). Di Jepang abad ke-4 mulai membudidayakan krisan, dan tahun 797
bunga krisan dijadikan sebagai simbol kekaisaran Jepang dengan sebutan
Queen of The East. Tanaman krisan dari Cina dan Jepang menyebar ke
kawasan Eropa dan Perancis tahun 1795. Tahun 1808 Mr. Colvil dari Chelsa
mengembangkan 8 varietas krisan di Inggris. Jenis atau varietas krisan
modern diduga mulai ditemukan pada abad ke-17. Krisan masuk ke Indonesia
pada tahun 1800. Sejak tahun 1940, krisan dikembangkan secara
komersial. Jenis dan varietas tanaman krisan di Indonesia umumnya
hibrida berasal dari Belanda, Amerika Serikat dan Jepang. Krisan yang
ditanam di Indonesia terdiri atas
(http://dongengdalam.blogspot.com/2007/09/bunga-krisan-menghias-harapan.html)
:
1. Krisan lokal (krisan kuno): berasal dari luar negri, tetapi telah
lama dan beradaptasi di Indoenesia maka dianggap sebagai krisan lokal.
Ciri-cirinya antara lain sifat hidup di hari netral dan siklus hidup
antara 7-12 bulan dalam satu kali penanaman. Contoh C. maximum berbunga
kuning banyak ditanam di Lembang dan berbunga putih di Cipanas
(Cianjur).
2. Krisan introduksi (krisan modern atau krisan hibrida): Hidupnya
berhari pendek dan bersifat sebagai tanaman annual. Contoh krisan ini
adalah C. indicum hybr. Dark Flamingo, C. ihybr. Dolaroid, C. i. Hybr.
Indianapolis (berbunga kuning) Cossa, Clingo, Fleyer (berbunga putih),
Alexandra Van Zaal (berbunga merah) dan Pink Pingpong (berbunga pink).
3. Krisan produk Indonesia : Balai Penelitian Tanaman Hias Cipanas telah
melepas varietas krisan buatan Indonesia yaitu varietas Balithi 27.108,
13.97, 27.177, 28.7 dan 30.13A.
Kegunaan tanaman krisan yang utama adalah sebagai bunga hias. Manfaat
lain adalah sebagai tumbuhan obat tradisional dan penghasil racun
serangga. Sebagai bunga hias, krisan di Indonesia digunakan sebagai
bunga pot dan bunga potong.
1.1.3.2 Perbanyakan Krisan
Menurut Rukmana dan Mulyana (2007) prinsipnya perbanyakan tanaman dapat
dilakukan dengan cara generatif (biji) dan vegetatif. Perbanyakan
generatif pada tanaman krisan jarang dilakukan petani, kecuali dalam
lingkungan penelitian atau pemuliaan tanaman untuk menghasilkan varietas
atau kultivar baru. Tanaman krisan bersifat heterezigot (macam ragam),
sehingga keturunan tanaman dari biji tidak selalu sama dengan iduknya.
Disamping itu perbanyakan generatifnya membutuhkan penanganan khusus
dalam waktu lama, sehingga kurang baik untuk dipraktekkan pada usaha
skala komersial.
Perbanyakan tanaman yang menjamin kepastian produksi adalah cara
vegetatif. Keturunan tanaman dari organ vegetatif sama dengan induknya.
Macam oragan vegetatif bahan perbanyakan tanaman krisan adalah anakan,
stek pucuk dan kultur in-vitro (mikropopagasi) yang popular disebut
kultur jaringan. Perbanyakan vegetatif dengan anakan umumnya dilakukan
pada krisan lokal. Pada lingkungan penelitian telah dikembangkan teknik
perbanyakan tanaman krisan secara kultur jaringan tanaman. Prinsip
perbanyakan kultur jaringan adalah memotong eksplan atau jaringan
tanaman berukuran kecil, kemudian ditanaman pada medium tumbuh buatan
secara aseptik. Berkenaan dengan usaha komersial, teknik perbanyakan
vegetatif pada tanaman krisan yang umum dipraktekkan adalah cara
konvesional yaitu dengan setek pucuk.
2.1.4 Semangka
2.1.4.1 Sekilas Tentang Semangka
Menurut Ashari (1995) semangka berasal dari daerah tropik dan subtropik
Afrika. Tumbuh liar di tepi jalan, padang belukar, pantai laut, atau
ditanam di kebun dan pekarangan sebagai tanaman buah. Semangka dapat
ditemukan dari dataran rendah sampai 1.000 m dpl. Tanaman semusim ini
tumbuh menjalar di atas tanah atau memanjat dengan sulur-sulur atau alat
pembelit. Batang lunak, bersegi dan berambut, panjangnya 1,5–5 m. Sulur
tumbuh dari ketiak daun, bercabang 2–3 cabang. Daun letak berseling,
bertangkai, helaian daun lebar dan berbulu, menjari, dengan ujung
runcing, panjang 3–25 cm, lebar 1,5–15 cm, tepi bergelombang, kadang
bergigi tidak teratur, permukaan bawah berambut rapat pada tulangnya.
Bunga uniseksual, keluar dari ketiak daun, tunggal, biasanya bunga
jantan lebih banyak, berbentuk lonceng lebar, warnanya kuning, mekar
pada pagi hari. Buah berbentuk bola sampai bulat memanjang, besar
bervariasi dengan panjang 20–30 cm, diameter 15–20 cm, dengan berat
mulai dari 4 kg sampai 20 kg. Kulit buahnya tebal dan berdaging, licin,
warnanya bermacam-macam seperti hijau tua, kuning agak putih, atau hijau
muda bergaris-garis putih. Daging buah warnanya merah, merah muda
(pink), jingga (orange), kuning, bahkan ada yang putih. Biji bentuk
memanjang, pipih, warnanya hitam, putih, kuning, atau cokelat kemerahan.
Ada juga yang tanpa biji (seedless). Biji yang sudah diolah disebut
kuaci. Semangka selain dimakan sebagai buah segar juga dapat diminum
sebagai jus. Buah semangka jangan dimakan dengan gula aren karena dapat
terbentuk racun, terutama sangat mengganggu pada orang yang
pencernaannya lemah. Racun ini dapat menimbulkan kejang-kejang dan diare
sampai menyebabkan kematian.
2.1.4.2 Perbanyakan Semangka
Fase generatif ditandai dengan keluarnya bunga. Pada fase ini tanaman
memerlukan banyak unsur fospor untuk memperkuat akar dan membentuk biji
pada buah. Pada fase ini apabila tanaman dalam kondisi sehat maka
jaring-jaring pada buah diharapkan muncul secara merata. Untuk mendukung
pertumbuhan generatif, tanaman disemprot dengan pupuk daun
Complesalsuper tonic (merah) dengan konsentrasi 2 gram/liter seminggu
sekali. Untuk mencegah kekurangan unsur kalsium dan boron maka tanaman
disemprot dengan pupuk daun Ferti-cal dengan konsentrasi 2 ml/liter
atau CaB dengan konsentrasi 2 ml/liter.
Dengan metode kultur jaringan pengadaan benih secara vegetatif (Kultur
Jaringan). Dengan metoda kultur jaringan, pemilihan media tanam dan
sumber eksplan yang digunakan harus tepat agar memberikan hasil yang
maksimal. Media dasar yang dipakai tersusun dari garam-garam berdasarkan
susunan Murashige & Skoog (1962) dengan penambahan thiamin 0,04
mg/liter, myo-inositol 100 mg/liter, surkosa 30 gram/liter berbagai
kombinasi hormon tanaman yang ditambahkan sesuai dengan perlakuan. Media
dibuat dalam bentuk padat dengan penambahan agar bacto 8 gram/liter, pH
media dibuat 5,7 dengan penambahan NaOH atau HCl 0,1 N. Sterilisasi
media dilakukan dengan autoklaf bertekanan 17,5 psi, suhu 120 derajat C
selama 30 menit. Tanaman yang didapat dari kultur jaringan membentuk
bunga jantan dan bunga betina separti halnya tanaman yang didapat dari
biji (Ashari, 1995).
2.2 Tinjauan Kultur Jaringan
Metode kultur jaringan pada mulanya merupakan penelitian laboratorium
sebagai bagian dari penelitian fisiologi tentang tumbuh dan berkembang
(growth & develompent), yang didasari oleh teori totipotensi sel,
yaitu bahwa setiap sel tanaman yang hidup dilengkapi dengan informasi
genetik dan perangkat fisiologis yang lengkap untuk tumbuh dan
berkembang menjadi tanaman yang utuh, jika kondisinya sesuai. Teori ini
pertama kali dikemukakan oleh Schwann dan Schleiden pada tahun 1838
(Yusnita, 2004). Kultur jaringan secara luas didefinisikan sebagai usaha
mengisolasi, menumbuhkan, memperbanyak dan meregenerasikan protoplas
(bagian hidup dari sel), atau bagian tanaman seperti meristem, tunas,
daun muda, batang muda, ujung akar, kepala sari, dan bakal buah dalam
media buatan secara aseptik yang kaya nutrisi dan zat pengatur tumbuh
dalam wadah tertutup yang tembus cahaya sehingga bagian tanaman tersebut
dapat memperbanyak diri dan bergenerasi menjadi tanaman lengkap.
Prinsip utama dari teknik kultur jaringan adalah perbayakan tanaman
dengan menggunakan bagian vegetatif tanaman menggunakan media buatan
yang dilakukan di tempat steril.
Kultur jaringan merupakan teknik perbanyakan tanaman alternatif yang
sangat efektif dan berpotensi untuk dikembangkan pada tanaman
hortikultura. Awal mula diaplikasikannya teknik kultur jaringan untuk
memperbanyak tanaman hortikultura adalah sekitar akhir tahun 1970-an dan
awal 1980-an. Pada waktu itu induksi kalus dan kultur tunas yang
diikuti oleh regenerasinya menjadi tanaman sempurna banyak digunakan.
Namun sekarang seiring dengan perkembangan yang lebih lanjut,
perbanyakan tanaman hortikultura secara in-vitro dapat diinduksi
melalaui pembentukan kalus, induksi tunas aksiler, induksi tunas
adventif, dan somatic embryogenesis. (Kamemoto dan Kuehnle, 1996 dalam
Rachmawati, 2005).
2.3 Embriogenesis Somatik
Perkembangbiakan dalam kultur jaringan dapat dilakukan melalui jalur
organogenesis dan embriogenesis somatik. Cara embriogenesis somatik
banyak mendapat perhatian karena jumlah propagul yang dihasilkan tidak
terbatas dan dapat diperoleh dalam waktu yang lebih singkat. Di samping
itu, untuk mendukung program pemuliaan tanaman melalui rekayasa
genetika, penggunaan embrio somatik dapat mempercepat keberhasilan
dengan peluang transformasi yang lebih tinggi karena embrio somatik
dapat berasal dari satu sel somatik. Untuk penyimpanan jangka pendek
maupun jangka panjang, embrio somatik dianggap merupakan bahan tanaman
yang ideal untuk disimpan karena apabila diregenerasikan dapat membentuk
bibit somatik. Selain keuntungan, terdapat beberapa kendala dalam
penerapan embriogenesis, yaitu peluang terjadi mutasi lebih tinggi,
metode lebih sulit, ada penurunan daya morfogenesis dari kalus
embriogenik karena subkultur berulang serta memerlukan penanganan yang
lebih intensif karena kultur lebih rapuh. Namun demikian, variasi yang
dihasilkan sering dianggap menguntungkan karena dapat digunakan sebagai
sumber keragaman genetik (gene pool).
Embriogenesis somatik merupakan suatu proses di mana sel somatik (baik
haploid maupun diploid) berkembang membentuk tumbuhan baru melalui tahap
perkembangan embrio yang spesifik tanpa melalui fusi garnet. Istilah
embrio somatik pertama kali digunakan oleh Tolkin pada tahun 1964 yang
menggambarkan pembentukan organisme dari suatu sel atau kumpulan sel
somatik. Embrio somatik dapat dicirikan dari strukturnya yang bipolar,
yaitu mempunyai dua calon meristem, yaitu meristem akar dan meristem
tunas. Dengan memiliki struktur tersebut maka perbanyakan melalui embrio
somatik lebih menguntungkan daripada pembentukan tunas adventif yang
unipolar. Di samping strukturnya, tahap perkembangan embrio somatik
menyerupai embrio zigotik. Secara spesifik tahap perkembangan tersebut
dimulai dari fase globular, fase hati, fase torpedo, dan planlet (Gaj,
2001 dalam Purnamaningsih, 2002).
Embrio somatik dapat terbentuk melalui dua jalur, yaitu secara langsung
maupun tidak langsung (melewati fase kalus). Keberhasilan akan tercapai
apabila kalus atau sel yang digunakan bersifat embriogenik yang
dicirikan oleh sel yang berukuran kecil, sitoplasma padat, inti besar,
vakuola kecil-kecil dan mengandung butir pati. Embrio somatik dapat
dihasilkan dalam jumlah besar dari kultur kalus, namun untuk tujuan
perbanyakan dalam skala besar, jumlahnya kadang-kadang dapat lebih
ditingkatkan melalui inisisasi sel embrionik dari kultur suspensi yang
berasal dari kalus primer (Wiendi et al., 1991 dalam Purnamaningsih,
2002). Embriogenesis mempunyai beberapa tahap spesifik, yaitu (1)
induksi sel dan kalus embriogenik, (2) pendewasan, (3) perkecambahan,
dan (4) hardening. Pada tahap induksi kalus embriogenik dilakukan
isolasi eksplan dan penanaman pada media tumbuh. Untuk induksi kalus
embriogenik kultur umumnya ditumbuhkan pada media yang mengandung auksin
yang mempunyai daya aktivitas kuat atau dengan konsentrasi tinggi. Dari
berbagai hasil penelitian menunjukkan bahwa 2,4-D merupakan auksin yang
efektif untuk induksi kalus embriogenik. Zat pengatur tumbuh tersebut
merupakan auksin sintetis yang cukup kuat dan tahan terhadap degradasi
karena reaksi enzimatik dan fotooksidasi. Di samping auksin, sering pula
diberikan sitokinin seperti benzil adedin (BA) atau kinetin secara
bersamaan (Bhojwani dan Razdan, 1989 dalam Purnamaningsih, 2002). Tahap
pendewasaan adalah tahap perkembangan dari struktur globular membentuk
kotiledon dan primordia akar. Beberapa hasil penelitian menunjukkan
bahwa tahap pendewasaan adalah tahap yang paling sulit. Pada tahap ini
sering digunakan auksin pada konsentrasi rendah. Tahap perkecambahan
adalah fase di mana embrio somatik membentuk tunas dan akar. Pada media
perkecambahan konsentrasi zat pengatur tumbuh yang digunakan sangat
rendah atau bahkan tidak diberikan sama sekali. Tahap hardening, yaitu
tahap aklimatisasi bibit embrio somatik dari kondisi in vitro ke
lingkungan baru di rumah kaca dengan penurunan kelembaban dan
peningkatan intensitas cahaya.
2.4 Faktor-faktor yang Mempengaruhi Embriogenesis Somatik
Menurut Purnamaningsih (2002) beberapa faktor yang mempengaruhi
pembentukan embrio somatic adalah jenis eksplan, sumber nitrogen dan
gula, serta zat pengatur tumbuh.
1. Jenis Eksplan
Penggunaan eksplan yang bersifat meristematik umumnya memberikan
keberhasilan pembentukan embrio somatik yang lebih tinggi. Eksplan yang
digunakan dapat berupa aksis embrio zigotik muda dan dewasa, kotiledon,
mata tunas, epikotil maupun hipokotil. Hasil penelitian Vesco dan Guerra
(2001) menunjukkan bahwa penggunaan embriozigotik dewasa (mature
zygotic Membriogenesis/ MZE) dapat menghasilkan embrio somatik yang
lebih banyak dalam waktu yang lebih cepat daripada immature zigotic
embryogenesis (IZE).
Sebaliknya hasil penelitian Gupta dan Crob (1995 dalam Purnamaningsih
(2002) pada tanaman cemara menunjukkan bahwa penggunaan embrio zigotik
muda (IZE) menghasilkan embrio somatik yang lebih banyak daripada embrio
zigotik dewasa (MZE). Dari beberapa hasil penelitian tersebut dapat
disimpulkan bahwa eksplan yang digunakan dapat berbeda tergantung jenis
tanaman dan tahap perkembangan (developmental stage) dari eksplan.
2. Sumber Nitrogen dan Gula
Embriogenesis somatik mengalami proses perkembangan morfologi seperti
yang terjadi pada embrio zigotik. Faktor yang penting dalam induksi danM
perkembangan embryogenesis somatik adalah komposisi nutrisi pada media
kul-tur. Nitrogen merupakan faktor uta-ma dalam memacu morfogenesis
secara in vitro. Menurut Ammirato (1983 dalam Purnamaningsih, 2002) )
bentuk nitrogen reduksi dan beberapa asam amino seperti glutamin dan
casein hidrolisat, sangat penting untuk inisiasi dan perkembanganm
embrio somatik. Penambahan asam amino dapat merangsang terjadinya
komunikasi di antara sel dan jaringan pada organ multiselular (Young et
al., 1999 dalam Vesco dan Guerra, 2001).
Untuk inisiasi dan pendewasaan embrio somatik diperlukan keseimbangan
yang te-pat antara NH4+ dan NO3- (Bhojwani dan Razdan, 1989).
Konsentrasi NO3- yang terlalu tinggi akan meningkatkan pH media sehingga
kalus tidak dapat membentuk embrio somatik. Hasil penelitian Vesco dan
Guerra (2001) pada tanaman Feijoa sellowiana menunjukkan bahwa
penggunaan NH4+ dan NO3– pada konsentrasi 15 : 34 dan 34 : 15 mM dengan
menggunakan medium LPm dapat menghasilkan jumlah embrio somatik
terbanyak/eksplan. Penambahan glutamin 4 mM meng-hasilkan induksi kalus
embriogenik tertinggi. Penggunaan NO3- (49 mM) sebagai sumber N tunggal
mengha-silkan jumlah embrio somatik yang rendah, tetapi ketika ke dalam
me-dia ditambahkan glutamin (4 mM) maka jumlah embrio somatik meningkat
hingga 5,8 kali setelah 10 minggu. Sedangkan apabila NH4+ digunakan
sebagai sumber N tunggal ternyata tidak terbentuk embrio somatik, selain
itu laju pertumbuhan kalus rendah dan kalus berwarna
coklat.
Induksi embrio somatik dipengaruhi oleh pH media kultur., Penggunaan
NO3- meningkatkan pH melalui eksresi HCO3- dari eksplan, sebaliknya
pemakaian NH4+ akan menurunkan pH. Dalam penelitian tersebut juga
ditelitipenggunaan beberapa sumber asam amino ter-hadap pembentukan
embrio soma-tik. Hasil yang diperoleh menunjuk-kan,bahwa penggunaan
asparagin, glutamin dan arginin sebesar 4 mM dapat meningkatkan jumlah
embrio somatik dibandingkan dengan kontrol, walaupun tidak ada perbedaan
yang nyata di antara respon peng-gunaan ketiga asam amino terse-but.
Menurut Lea (1993) dalam Vesco dan Guerra (2001) nitrogen yang berasal
dari asam amino diasi-milasikan mdengan cepat menjadi karbon skeleton
selama metabo-lisme dan digunakan untuk sintesis protein.
Selain itu, asam amino dapat meningkatkan perkembangan yang sinkron
(synchronous development) menjadi torpedo dan kotiledon. Selain
nitrogen, gula merupakan salah satu komponen organic yang harus
diberikan ke dalam media tumbuh. Gula berfungsi di samping sebagai
sumber karbon, juga berguna untuk mempertahankan tekanan osmotik media.
Anhazhagan dan Ganapathi (1999) melakukan penelitian tentang
embryogenesis somatik dalam kultur supensi pigeonpea (Cajanus cajan).
BAB 3. BAHAN DAN METODE
3.1 Waktu dan Tempat
Praktikum Produksi Bibit Tanaman Anthurium, Nanas, Krisan dan Semangka
dilaksanakan pada bulan Februari 2009 – Juni 2009, setiap hari Senin dan
Kamis. Praktikum ini dilaksanakan di laboratorium kultur jaringan
Politeknik Negeri Jember.
3.2 Alat dan Bahan
Alat-alat yang digunakan yaitu : laminar air flow cabinet (LAFC),
autoklaf elektrik, kompor gas, botol kultur, alat diseksi (pinset,
skalpel), rak dorong, petridis, erlenmayer, gelas ukur, hansprayer,
lampu bunsen, gunting, kamera, beaker glass, timbangan digital,
timbangan analitik, hot plate, magnetik stirrer, pH meter, kulkas,
fresser, pipet tetes, pipet lurus, mikro pipet, poci ukur, mistar, alat
pencuci, spatula, shaker, stopwatch, ember, sprayer, dan sendok.
Bahan-bahan yang digunakan yaitu : unsur hara makro, unsur hara mikro,
unsur hara besi, vitamin, zat pengatur tumbuh (ZPT), sukrosa, gula
pasir, agar-agar, tisu, alkohol 96 %, alkohol 70 %, klorok, spirtus,
mata pisau, eksplan bunga lili, planlet lili, bakterisida, detergen,
fungisida, rifamficine, air kran, air destilata, air destilata steril,
plastik wraffing, plastik penutup media, karet gelang, kertas label,
spidol, korek api, tabung gas, NaOH, HCL, alumunium foil, kertas, pot,
media pakis, dan kain.
4.1.2 Pembahasan
Multiplikasi merupakan tahap perbanyakan untuk menggandakan propagul
atau bahan tanaman seperti tunas, atau embrio serta memeliharanya dalam
keadaan tertentu sehingga sewaktu-waktu bisa dilanjutkan untuk tahap
berikutnya (Yusnita, 2004). Multiplikasi dilaksanakan dalam kondisi yang
steril, oleh karena itu ruangan tempat kerja harus disterilisasi
menggunakan alkohol 70% agar bakteri atau jamur yang menempel pada meja
kerja mati.
Multiplikasi dapat dilakukan dengan melihat dari beberapa komponen yaitu
media sudah menipis sehingga unsur haranya sudah habis, pertumbuhan
sudah memenuhi botol dan bila membutuhkan sesuai waktu yang ditentukan.
Multiplikasi dapat dilakukan dengan 3 (tiga) cara yaitu penjarangan
untuk anggrek melalui biji, pemecahan (spliting) dan pemotongan
(cutting) (Sugito, 2007). Multiplikasi yang dilakukan untuk anthurium
dengan cara pemecahan propagul dan tunas sampai propagul pada ujung
bawah menempel. Multiplikasi dapat dilakukan secara berulang-ulang
sampai dicapai jumlah propagul yang diharapkan tanpa mengorbankan
kualitas tunas. Menurut Yusita (2004) multiplikasi yang terlalu banyak
dapat menurunkan mutu tunas seperti terjadinya vitrifikasi (suatu gejala
ketidaknormalan fisiologis) dan aberasi (penyimpangan genetik). Keadaan
ini terjadi karena semakin besar multiplikasi dilakukan berarti semakn
sering tanaman dikondisikan dalam media yang mengandung sitokinin,
sehingga daya regenerasi meningkat.
Formulasi tersebut merupakan interaksi antara IBA yang merupakan
golongan auksin dan BAP yang merupakan golongan Sitokinin. Menurut
Yusnita (2004) sitokinan tersebut pada kultur jaringan bertujuan untuk
menumbuhkan dan menggandakan tunas aksilar atau merangsang tumbuhnya
tunas-tunas adventif. Sedangkan konsentrasi 4 ppm IBA berinteraksi untuk
membentuk kalus. Kalus adalah kumpulan sel amorphous yang terjadi dari
sel-sel jaringan yang membelah diri secara terus menerus (Gunawan,
1992). Definisi kalus menurut Yusnita (2004) adalah kumpulan sel yang
tidak terorganisasi dan aktif membelah diri (meristematik) yang sering
terjadi karena pelukaan jaringan tanaman atau pengulturan berbagai
jaringan tanaman.
4.2.2 Pembahasan
Tabel 2. Menunjukkan hasil inisiasi dengan tingkat kontaminasi yang
masih tinggi pada minggu pertama. Kontaminasi merupakan salah satu
faktor penyebab kegagalan dalam teknik kultur in vitro yaitu munculnya
mikroorganisme seperti jamur atau bakteri pada permukaan eksplan atau
pada media. Kontaminasi yang disebabkan oleh jamur ditandai dengan
munculnya benang-benang yang berwarna putih, yang merupakan miselium
jamur. Jamur dapat menginfeksi jaringan secara sistemik (secara umum
tersebar di seluruh organ) sehingga lama kelamaan dapat menyebabkan
jaringan eksplan akan mati. Sedangkan kontaminasi yang disebabkan oleh
bakteri munculnya bercak-bercak putih dan pada medium terlihat agak
berlendir dan bergelembung. Menurut Yusnita (2004) kontaminasi yang
disebabkan oleh mikroorganisme endofitik (mikroorganisme yang hidup di
dalam sel atau ruang antar sel tanaman) yang sering merupakan biota dari
tanaman sumber eksplan, sulit diatasi dengan sterilisasi permukaan.
Tingkat kontaminasi terjadi karena belum cocok antara bahan sterilan
dengan kondisi eksplan. Menurut Sunarjono (2002) ruangan yang sudah
steril dapat saja berubah menjadi tidak seril pada saat musim hujan,
sehingga dapat membawa masuknya bakteri dan jamur dari luar serta dapat
meningkatkan kelembaban yang akan mempercepat perkembangan
mikroorganisme. Selain hal itu penyebab terjadinya kontaminasi
disebabkan karena eksplan yang digunakan berasal dari (green house) yang
tidak dirawat dengan baik mulai dari penyiraman, pengendalian hama dan
penyakit tetapi dibiarkan begitu saja langsung di inisiasi bukan eksplan
yang berasal dari teknik rejuvenasi yang diperlihara dan dirawat di
green house dalam keadaan sehat dan steril. Media yang digunakan juga
berpengaruh terhadap kontaminasi tersebut. Media yang digunakan yaitu
media MS lengkap yang merupakan media kaya unsur hara. Santoso dan
Nursandi (2002) mengemukakan bahwa semakin sederhana komponen media maka
semakin rendah kemungkinan terjadinya kontamiasi. Herawan dan Hendrarti
(1996) dalam Rezkita (2007) menambahkan bahwa tingkat kontaminasi juga
berasal dari eksplan baik intenal maupun eksternal, air yang digunakan,
botol-botol kultur atau alat-alat yang kurang steril, spora-spora yang
terdapat dalam ruang kultur dan kecerobohan dalam pelaksanaan. Yunita
(2004) menyebutkan bahwa untuk mengatasi masalah kontaminasi yang
peristen dapat dilakukan cara-cara pencucian ulang dengan sodium
hopoklorit dengan konsentrasi rendah, seperti pemutih pakaian 5 %,
penggunaan media yang mengandung antibiotik, penggunaan eksplan
berukuran sekecil mungkin seperti meristem dengan beberapa primordia
daun dan pemotongan bagian teratas eksplan yang telah tumbuh.
4.3 Krisan
4.3.2 Pembahasan
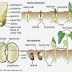
Tabel 3 dan gambar 3 menunjukan tingkat kontaminasi yang masih tinggi
pada minggu pertama. Tingkat kontaminasi terjadi karena belum cocok
antara bahan sterilan dengan kondisi eksplan. Kontaminasi merupakan
salah satu faktor penyebab kegagalan dalam teknik kultur in vitro yaitu
munculnya mikroorganisme seperti jamur atau bakteri pada permukaan
eksplan atau pada media. Menurut Yusnita (2004) kontaminasi yang
disebabkan oleh mikroorganisme endofitik (mikroorganisme yang hidup di
dalam sel atau ruang antar sel tanaman) yang sering merupakan biota dari
tanaman sumber eksplan, sulit diatasi dengan sterilisasi permukaan.
Sunarjono (2002) menambahkan ruangan yang sudah steril dapat saja
berubah menjadi tidak seril pada saat musim hujan, sehingga dapat
membawa masuknya bakteri dan jamur dari luar serta dapat meningkatkan
kelembaban yang akan mempercepat perkembangan mikroorganisme. Selain hal
itu penyebab terjadinya kontaminasi disebabkan karena eksplan yang
digunakan berasal dari (green house) yang tidak dirawat dengan baik
mulai dari penyiraman, pengendalian hama dan penyakit tetapi dibiarkan
begitu saja langsung di inisiasi bukan eksplan yang berasal dari teknik
rejuvenasi yang diperlihara dan dirawat di green house dalam keadaan
sehat dan steril. Media yang digunakan juga berpengaruh terhadap
kontaminasi tersebut.
Herawan dan Hendrarti (1996) dalam Rezkita (2007) menambahkan lagi bahwa
tingkat kontaminasi juga berasal dari eksplan baik intenal maupun
eksternal, air yang digunakan, botol-botol kultur atau alat-alat yang
kurang steril, spora-spora yang terdapat dalam ruang kultur dan
kecerobohan dalam pelaksanaan. Yunita (2004) menyebutkan bahwa untuk
mengatasi masalah kontaminasi yang peristen dapat dilakukan cara-cara
pencucian ulang dengan sodium hopoklorit dengan konsentrasi rendah,
seperti pemutih pakaian 5 %, penggunaan media yang mengandung
antibiotik, penggunaan eksplan berukuran sekecil mungkin seperti
meristem dengan beberapa primordia daun dan pemotongan bagian teratas
eksplan yang telah tumbuh.
4.4 Semangka
Tabel 4 menunjukkan data pengamatan hasil inisiasi biji semangka. Biji
tersebut mulai muncul tunas pada umur 3 minggu setelah inisiasi. Media
yang digunakan yaitu media MS 0. Hasil ini menunjukkan respon yang
sangat bagus dimana pada umur 3 minggu sudah muncul tunas. Interaksi
antara media MS dan eksplan sangat bagus. Pada hasil inisiasi semangka
ini tidak terjadi kontminasi yang merupakan hasil yang paling bagus
diantara tanaman hortikultura yang di ditanam dari mulai tahap 0
(inisiasi). Hal ini disebabkan karena pada saat sterilisasi menggunaak
HgCl2 sebanyak 0,01 g/100 ml, selain itu eksplan yang digunakan adalah
benih yang sudah ada dipasaran yang dikemas sehingga bahan penyebab
kontaminasi kurang atau bahkan tidak ada. Hal ini masih perlu dilakukan
pengamatan lanjutan untuk melihat pengaruh intraksi tersebut untuk
melihat hasil yang maksimal dan pekerjaannya perlu dilanjutkan seperti
multiplikasi, pengakaran dan aklimatisasi.
DAFTAR PUSTAKA
Ashari, S. 1995. Hortikultura Aspek Budidaya. Jakarta: UI Press
Budhiprawira, S dan D. Saraswati. 2007. Seri Agrihobi Anthurium.
Jakarta: Penebar Swadaya.
Ekawati, E. 2008. Mikrpropagasi Tanaman Hortiukutura. Modul PJJ (Tidak
Dipublikasikan). Cianjur: PPPTK Pertanian
Gunawan, L.W. 1992. Teknik Kultur Jaringan Tumbuhan. Bogor: Institut
Pertanian Bogor.
http://dongengdalam.blogspot.com/2007/09/bunga-krisan-menghias-harapan.html
http://id.wikipedia.org/wiki/Anthurium
Purnamaningsih,
R. 2002. Regenerasi Tanaman melalui Embriogenesis Somatik dan Beberapa
Gen yang Mengendalikannya. Balai Penelitian Bioteknologi dan Sumberdaya
Genetik Pertanian. Buletin AgroBio 5(2):51-58.
Purwito, A. (Tanpa Tahun). Kultur Jaringan Tanaman. Insitut Pertanian
Bogor. Bogor
Rachmawati, F. 2005. Kultur Anther Anthurium. Tesis (Tidak
Dipublikasikan). Institut Pertanian Bogor.
Rezkita, S. 2007. Teknik Perbanyakan Tanaman Pulai (Alstonia scholaris
R. Brown) dengan Eksplan Pucuk Aksilar melalui Kultur Jaringan Di
Laboratorium Pusat Penelitian dan Pengembangan Hutan Tanaman (P3HT)
Kaliurang, Jogjakarta. Jogjakarta: Skripsi Fakultas MIPA Universitas
Negeri Yogyakarta.
Rukmana, R. (2001). Nenas Budidaya dan Pasca Panen. Yogyakart: Kanisius
Rukmana, R dan A.S. Mulyana. 2006. Krisan. Yogyakarta: Kanisius
Sugito, H. 2007. Kultur Jaringan Tanaman. Bahan Kuliah (Tidak
dipublikasikan) Cianjur: PPPPTK Pertanian..
Yusnita. 2004. Kultur Jaringan Cara Memperbanyak Tanaman Secara Efisien.
Jakarta: Agromedia Pustaka.











0 comments:
Post a Comment